Voorwaarden en regels voor nieuwe voedingsmiddelen
In Voeding Nu is een artikel gepubliceerd over de voorwaarden en regels voor nieuwe voedingsmiddelen. Onze novel food collega’s Marjolein van der Spiegel en José van den Driessche hebben met vier andere novel food adviseurs samengewerkt aan dit artikel. De publicatie beschrijft wanneer ingrediënten en voedingsmiddelen beschouwd worden als novel foods, de voorwaarden voor toelating, de beoordelingsprocedure en bescherming van gegevens.
Ons novel food team ondersteunt innovatieve bedrijven bij het bepalen of een product onder de novel food wetgeving valt, bij het samenstellen en indienen van novel food dossiers, en tijdens het proces na indiening bij de EC en EFSA. De strategie voor het samenstellen van een dossier is voor ieder novel food verschillend en we helpen daarom met het maken van beslissingen, bijvoorbeeld over welke data er verzameld moeten worden, hoe studies uitgevoerd kunnen worden, en hoe gegevens beschermd kunnen worden.
Lees het artikel op Voeding Nu of lees hier onder verder
In de EU zijn Nieuwe Voedingsmiddelen (Novel Foods) gedefinieerd als: alle levensmiddelen die binnen de EU vóór 15 mei 1997 niet in significante mate voor menselijke voeding werden gebruikt. Dit kunnen voedingsmiddelen zijn die niet eerder door mensen werden geconsumeerd (binnen de EU) of die met behulp van nieuwe technologieën zijn geproduceerd.
Sinds 1 januari 2018 is Verordening (EU) nr. 2015/2283 van kracht; deze bepaalt dat Nieuwe Voedingsmiddelen pas op de markt mogen nadat toelating is verkregen. De Verordening omvat een procedure voor bepalen van het al dan niet ‘nieuw/(novel)’ zijn van een voedingsmiddel of ingrediënt, een aanvraagprocedure, en een kennisgevingsprocedure voor traditionele levensmiddelen uit derde landen.
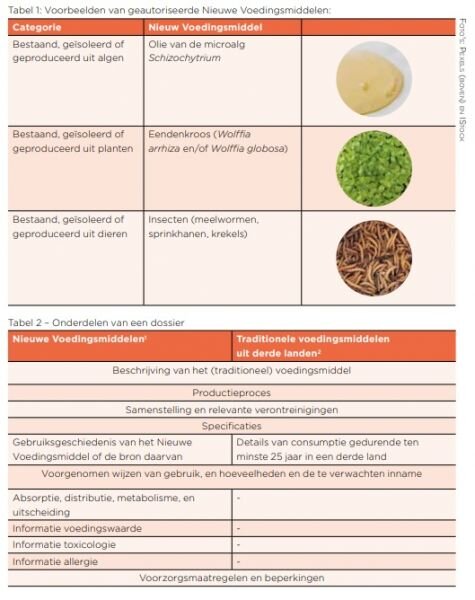
De Verordening onderscheidt de volgende categorieën Nieuwe Voedingsmiddelen:
· bestaand, geïsoleerd of geproduceerd uit micro-organismen, schimmels of algen; planten; dieren; celcultuur of weefselkweek afgeleid van deze bronnen; materiaal van minerale oorsprong; technisch vervaardigd nanomateriaal;
· met een nieuwe of doelbewust gemodificeerde molecuulstructuur;
· die voortkomen uit een nieuw productieproces.
De Unielijst van toegelaten Nieuwe Voedingsmiddelen vermeldt alle door de Europese Commissie (EC) met instemming van de lidstaten toegelaten Nieuwe Voedingsmiddelen, inclusief eventuele aanvullende voorwaarden voor gebruik. (Voorbeelden in Tabel 1). Hierin worden alle door de Europese Commissie (EC) toegelaten Nieuwe Voedingsmiddelen vermeld, inclusief eventuele aanvullende voorwaarden voor gebruik. Voorbeelden van toegelaten Nieuwe Voedingsmiddelen zijn olie van algen, eendenkroos, en insecten (Tabel 1).
Sommige levensmiddelen zijn buiten de EU aantoonbaar minstens 25 jaar ononderbroken in significante mate voor menselijke voeding gebruikt. Op basis daarvan kan een kennisgeving worden gedaan aan de Europese Commissie en op basis daarvan een vergunning verkregen, zonder de noodzaak van veiligheidsonderzoek. Veiligheid wordt dan verondersteld op basis van het feit dat het product langdurig is geconsumeerd - zonder bekende problemen.
Voorwaarden voor toelating
De EU laat een Nieuwe Voedingsmiddel alleen toe onder de volgende voorwaarden:
a) het levensmiddel levert volgens de beschikbare wetenschappelijke bewijzen geen veiligheidsrisico voor de menselijke gezondheid op…;
b) het beoogde gebruik van het levensmiddel is niet misleidend voor de consument…;
c) indien het levensmiddel bedoeld is ter vervanging van een ander levensmiddel, verschilt het daar niet zodanig van dat de normale consumptie ervan uit voedingsoogpunt nadelig voor de consument is.
Op basis van een wetenschappelijk dossier dat de aanvrager opstelt beoordeelt de Europese Autoriteit voor Voedselveiligheid (EFSA) of aan deze voorwaarden is voldaan ; zie Tabel 2 voor de onderdelen die zo’n aanvraag dient te bevatten.
Beoordelingsprocedure
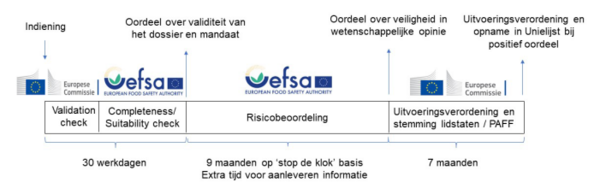
Na het indienen van een aanvraag bij de EC die positief beoordeeld wordt, duurt het verkrijgen van een vergunning tenminste 17 maanden (Figuur 1). Zodra de EC de aanvraag valide acht en EFSA de geschiktheid heeft geëvalueerd (30 werkdagen), beoordeelt EFSA de inhoud van het wetenschappelijke dossier. Dat kan tot negen maanden duren, plus eventueel de tijd die de aanvrager nodig heeft om tussentijdse vragen te beantwoorden - dan staat de klok tijdelijk stil. EFSA komt al dan niet tot de onderbouwde conclusie dat het Nieuwe Voedingsmiddel veilig is onder de gestelde gebruiksvoorwaarden. Op basis daarvan stelt de EC na zeven maanden een uitvoeringsverordening voor, welke na stemming door vertegenwoordigers van de lidstaten wordt toegevoegd aan de Unielijst . Vanaf het moment dat een aanvraag voor toelating van een Nieuw Voedingsmiddel wordt ingediend kunnen we het, indien het oordeel positief is, op zijn vroegst na twee tot drie jaar op de markt verwachten.
Bescherming van gegevens
Het opstellen van een aanvraag van een EU vergunning voor een Nieuw Voedingsmiddel is kostbaar. Om bedrijven de gelegenheid te bieden deze investering terug te verdienen kan de EC bij toelating van het Nieuwe Voedingsmiddel de producent ervan voor vijf jaar het alleenrecht op het vermarkten van dat Nieuwe Voedingsmiddel verlenen. Dat houdt in dat andere bedrijven die hetzelfde Nieuwe Voedingsmiddel op de markt willen brengen, zich gedurende vijf jaar niet kunnen beroepen op de veiligheidsdata (bijvoorbeeld toxiciteitsdata) die door het bedrijf dat de goedkeuring heeft verkregen zijn gegenereerd en gefinancierd. Dit wordt “proprietary data protection genoemd”. De voorwaarden voor het verkrijgen van proprietary databescherming zijn vastgelegd in de Verordening.
Voorwaarden toelating (non-EU)
Veel landen kennen inmiddels regels voor veiligheidsbeoordeling van Nieuwe Voedingsmiddel en ingrediënten als voorwaarde voor markttoelating, onder andere in de USA, het Verenigd Koninkrijk, Singapore, China, Canada, Australië en Nieuw-Zeeland. Meestal maakt een vergunning in de EU een toelating elders gemakkelijker; andersom in mindere mate.
De Verenigde Staten hanteren een ander systeem: Generally Recognized As Safe of 'GRAS'. Bij een self-affirmed GRAS wordt dit alleen beoordeeld door een zelf samen te stellen panel van onafhankelijke experts. Met een positieve beoordeling kan een bedrijf zijn voedingsmiddel of ingredient verkopen in de VS. De Amerikaanse Food and Drug Administration (FDA) kan alleen interveniëren als er daarvoor aanleiding is, bijvoorbeeld als er aanwijzingen zijn dat een product niet veilig is voor consumenten, of als er sprake is van misleiding. In de praktijk wordt de FDA wel vaak geraadpleegd, waarop een 'GRAS notification' volgt, vooral bij ingrediënten die worden verkocht aan grotere, gerenommeerde voedingsmiddelenbedrijven. De lijst van succesvol afgeronde GRAS notificaties in de VS bevat inmiddels ruim 1000 vermeldingen. Het aantal ‘self-affirmed GRAS’ producten is niet bekend, maar is waarschijnlijk beduidend hoger. De regelgeving verschilt van die in de EU, maar de onderliggende wetenschappelijke veiligheidsbeoordeling is vergelijkbaar.
Het Verenigd Koninkrijk hanteert de EU wetgeving vooralsnog ongewijzigd, als 'retained law'. De evaluatie wordt gedaan door het onder de Food Standards Agency (FSA) vallende Advisory Committee on Novel Foods and Processes (ACNFP).
Bron: Voeding Nu
Referenties:
Adviseurs Nieuwe Voedingsmiddelen
in Nederland: HV: https://www.fsnconsultancy.nl ; JvdD&MvdS: https://www.schuttelaar.nl/ ; CK: https://www.lsbi.eu/ ; SL: http://www.nutriclaim.com/ ; LP: https://loekintofood.com/
https://eur-lex.europa.eu/legal-content/en/TXT/?uri=CELEX%3A32015R2283
https://food.ec.europa.eu/safety/
novel-food/authorisations/
union-list-novel-foods_en
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX:32015R2283
https://www.efsa.europa.eu/en/topics/topic/novel-food en https://food.ec.europa.eu/safety/novel-food_en
https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2021.6555
https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2021.6557
https://food.ec.europa.eu/safety/
novel-food/authorisations/
union-list-novel-foods_en
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A32018R0456
https://webgate.ec.europa.eu/fip/novel_food_catalogue/
https://ec.europa.eu/food/safety/novel_food/consultation-process_en
https://www.food.gov.uk/research/
novel-and-non-traditional-foods-additives-and-processes/comparing-international-approaches-to-food-safety-regulation-of-gm-and-novel-foods
https://www.fda.gov/food/
food-ingredients-packaging/
generally-recognized-safe-gras en
https://www.cfsanappsexternal.fda.gov/scripts/fdcc/index.cfm?set=GRASNotices
&sort=GRN_No&order=DESC&startrow=
1&type=basic&search=
https://www.food.gov.uk/
business-guidance/regulated-products/novel-foods-guidance
https://acnfp.food.gov.uk/ACNFPOurMembers











